广州圣白树国际贸易有限公司 译
摘自《Journal of Animal Science》2007. 85:486-493;原文作者Piva A. et al.
摘要:本试验通过测定山梨酸和香草醛标记物的体内浓度,旨在研究微囊包埋及未包埋的有机酸(OA)和天然等同香料(NIF)的代谢途径,及其对肠道微生物代谢带来的可能影响。试验从3个处理中选取15只断奶仔猪,于体重29.5 ± 0.27 kg时屠宰。试验日粮分别为(1)对照日粮;(2)对照日粮添加OA和NIF混合物,用氢化植物油进行微囊包埋(保护混合物,以下简称PB);(3)对照日粮添加相同OA和NIF混合物,并添加同种氢化植物油粉末,但有效成分不经微囊包埋(未保护混合物,以下简称NPB)。采集胃、空肠头段、空肠尾段、回肠、盲肠和结肠样本,以山梨酸和香草醛作为示踪物,测定其在胃肠道内容物中的浓度。对照组仔猪肠道未检测出山梨酸和香草醛,PB组和NPB组胃中山梨酸和香草醛浓度无差异。与胃中浓度相比,仔猪饲喂包膜混合物,肠道中示踪物的浓度逐渐下降,未包膜混合物组示踪物在空肠头段及其后部浓度下降。PB组仔猪肠道山梨酸和香草醛浓度显著高于NPB组(P=0.02),空肠尾段和盲肠中大肠菌群数量显著低于对照和NPB组(P=0.03)。对照及PB组仔猪盲肠乳酸菌数量显著高于NPB组(P=0.03),其中NPB组空肠尾段中乳酸浓度显著下降(P=0.02),pH值显著升高(P=0.02)。采用微囊包埋技术将有机酸和天然等同香料用脂质保护层包埋起来,可确保活性成分缓慢释放,并防止活性成分在胃内迅速损失。
关键词:微囊包埋、天然等同香料、有机酸、缓释、猪
前言
随着欧盟禁止使用抗生素作为生长促进剂(第1831/2003/CE号法规),此后的研究一直致力于研究各种饲喂策略,如预防日粮营养吸收不良、肠道发酵不平衡以及腹泻等。有机酸(OA)常用作防腐剂,以防止食品和饲料腐败变质(Frank, 1994)。因此,给畜禽尤其是猪饲喂有机酸用来控制胃中微生物平衡的做法目前已被广泛接受。
某些植物精油具有抗菌作用(Guenther, 1948; Boyle, 1955),这得益于其中的酚类物质(Cosentino et al., 1999)。美国食品和药物管理局认为这些天然化合物基本上是安全的(FDA, 2006),因此使用这些物质防止食源性病原菌或腐败菌生长越来越受到关注。有机酸或植物精油调节肠道菌群的有效剂量存在固有局限性,这主要是因为这些物质在进入十二指肠前就被迅速吸收和代谢。而这一缺点可通过微囊包埋技术克服,该技术将活性成分包埋在保护层中,而在通过肠道的时候溶解。
微囊包埋技术应用广泛,如延缓药物的吸收(Piva et al., 1997),保护氨基酸和蛋白质在瘤胃中不被降解(Noel, 2000),还可以用于处理刺激性或腐蚀性产品。
本实验通过测定标记物山梨酸和香草醛的体内浓度,旨在研究微囊包埋及未包埋的有机酸(OA)和天然等同香料(NIF)的代谢途径,及其对肠道微生物代谢带来的可能影响。
材料与方法
动物与日粮
试验选取75头仔猪(77日龄,Goland×杜洛克,VailatiFacchini农场提供;初始体重23.1±3.5kg),分为3个日粮处理连续饲喂15天(见表1):(1)对照日粮;(2)对照日粮添加微囊包埋的OA和NIF混合物(PB),每千克日粮包含4g有机酸和天然等同香料(有机酸:富马酸760mg/kg、苹果酸360mg/kg、柠檬酸360mg/kg、山梨酸440mg/kg,天然等同香料:香草醛23mg/kg、百里香酚11mg/kg),包埋成分为氢化植物油(C12:0, 0.15%; C14:0, 1.38%;C16:0, 60.46%; C18:0, 37.25%; C20:0, 0.42%; 所有值均为饲喂基础);(3)对照日粮添加相同OA和NIF混合物,但有效成分不经微囊包埋(未保护混合物,以下简称NPB),并添加相同量的同种氢化植物油粉末,以消除PB组脂质保护层带来的差异。PB组所用微囊包埋有机酸和天然等同香料混合物由意大利Vetagro公司提供。PB和NPB组均添加山梨酸和香草醛作为标记物,采用HPLC法测定胃肠道中标记物的含量。
表1 试验日粮的原料及营养成分
项目 | 实验日粮1 | ||
对照组 | PB | NPB | |
原料 | |||
玉米 | 25.4 | 25.4 | 25.4 |
大麦 | 10.5 | 10.5 | 10.5 |
压片大麦 | 20.7 | 20.7 | 20.7 |
大豆油 | 3.5 | 3.5 | 3.5 |
干燥甜乳清粉 | 5 | 5 | 5 |
小麦麸 | 10.2 | 9.8 | 9.8 |
豆粕(44%) | 17.0 | 17.0 | 17.0 |
马铃薯蛋白2 | 3.5 | 3.5 | 3.5 |
石粉CaCO3 | 0.4 | 0.4 | 0.4 |
硫酸钙CaSO4 | 0.6 | 0.6 | 0.6 |
磷酸二氢钙Ca(H2PO4)2 | 1.6 | 1.6 | 1.6 |
氯化钠NaCl | 0.3 | 0.3 | 0.3 |
DL-蛋氨酸 | 0.16 | 0.16 | 0.16 |
L-赖氨酸盐酸盐 | 0.4 | 0.4 | 0.4 |
L-苏氨酸 | 0.16 | 0.16 | 0.16 |
L-色氨酸 | 0.04 | 0.04 | 0.04 |
维生素/矿物质预混料3 | 0.5 | 0.5 | 0.5 |
微囊包埋混合物 | — | 0.4 | — |
未包埋混合物 | — | — | 0.4 |
营养成分,占干物质比例 | |||
干物质,% | 90.86 | 90.86 | 90.96 |
粗蛋白 | 19.3 | 19.08 | 19.16 |
乙醚提取物 | 6.74 | 6.76 | 7.02 |
粗纤维 | 5.01 | 4.96 | 4.97 |
灰分 | 6.84 | 6.61 | 6.62 |
淀粉 | 39.61 | 37.99 | 37.95 |
营养价值4,MJ/kg 干物质 | |||
代谢能 | 16.07 | 16.07 | 16.07 |
净能 | 11.51 | 11.51 | 11.51 |
1对照日粮;PB=对照日粮添加微囊包埋OA和NIF混合物;NPB=对照日粮添加未包埋相同OA和NIF混合物。
2购于Protastar公司,Kalmi Italia, Desenzano del Garda (BS), Italy.
3预混料组成(每kg日粮,饲喂基础):维生素A 18,000 IU;维生素D3 2,400 IU;维生素E98 IU;硫胺素 3 mg核黄素7.2mg;吡哆醇 6 mg;泛酸 24 mg;生物素 240μg;维生素C 90 mg;维生素K 4.8 mg;盐酸 30 mg维生素B12 36g;叶酸1.8 mg;氯化胆碱 480 mg;CoCO3·3Co(OH)·2H2O,480μg;FeCO3, 300 mg;Ca(IO3)2, 1.8 mg;MnO2, 48 mg;CuSO4·5H2O,
120 mg;Na2SeO3, 120 μg;ZnO, 240 mg。
4代谢能按照Whittemore (1980)方法测定;NE按照Noblet et al.(1994)方法测定。
仔猪采用栏养(每个处理5栏,每栏5只猪),整个试验期内自由采食饲料和饮水直至屠宰。试验期间控制室温(27.4 ± 0.96°C),采用自然光照(9月,每天12h光照)。92日龄时每栏选取一只猪(体重29.5 ± 0.27 kg),在CERZOO实验室兽医监督下于30min内屠宰,采用电击致晕后放血。
致死后立刻采集胃、空肠头段、空肠尾段、回肠、盲肠和结肠(乙状弯曲处)内容物样本(截取每段肠段去除水分收集内容物),测定食糜中山梨酸和香草醛的浓度。计数空肠尾段和结肠食糜中乳酸菌和大肠菌群的数量。样本采集后立刻保存于-20℃,测定山梨酸、香草醛、短链脂肪酸和氨的浓度;样本采集后立即测定pH值和微生物数量。
饲料和肠道内容物成分分析
测定饲料营养成分(干物质、粗灰分、淀粉、粗蛋白、粗脂肪、粗纤维,见表1)。测定肠道内容物中山梨酸、香草醛、短链脂肪酸浓度以及pH值。山梨酸和香草醛浓度采用高效液相色谱法测定,氨浓度采用酶试剂盒法测定,短链脂肪酸和乳酸浓度采用气相色谱法测定,具体操作参考说明书。
细菌计数
取1g空肠尾段和盲肠内容物样品,连续10倍稀释,接种到Rogosa琼脂平板上进行乳酸菌计数,接种到紫红胆汁琼脂平板上用于大肠菌群的计数。每个处理5个重复,具体操作参考说明书。
数据分析
试验结果以“平均值±标准误”表示,P<0.05时差异显著。PB和NPB组各段胃肠道内山梨酸和香草醛浓度采用未配对t检验;同一处理内,各段胃肠道内山梨酸和香草醛浓度采用单因素方差分析。比较3个处理中(对照、PB和NPB组),胃肠道同一位点的氨和短链脂肪酸浓度、pH值、微生物平板计数差异,处理间差异显著性采用方差分析。当检测到处理效应时,使用Newman-Keuls检验分离平均值。数据分析采用GraphPad Prism程序。
实验结果
动物健康状况
试验期间,负责动物福利的兽医未发现任何明显的临床病症。因此试验期间未进行任何医疗干预或处理,也没有出现仔猪死亡。
饲料和肠道内容物成分分析
不同处理间,各段肠道内容物食糜干物质含量不存在显著差异(P > 0.41)。对照组仔猪胃肠道内未检出山梨酸(<0.45 nmol/g),PB和NPB组仔猪胃内容物中山梨酸浓度无差异((P = 0.61,PB组7.76 ± 1.14μmol/g DM,NPB组7.00 ± 0.87 μmol/g DM)。与此相反,PB组各段肠道内容物中山梨酸浓度均高于NPB组(P = 0.02)。NPB组仔猪仅在空肠头段和尾段检测出山梨酸,而回肠、盲肠和结肠中均未检出(图1)。
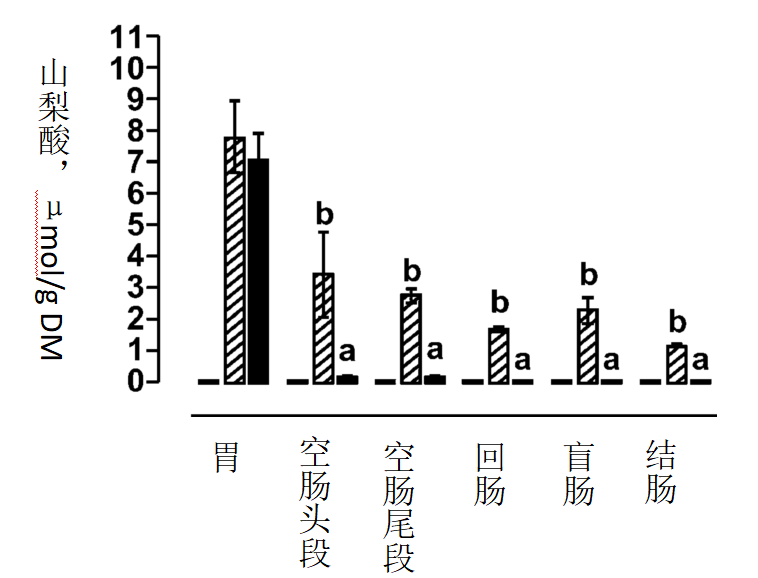
图1测定各处理组仔猪胃肠道中山梨酸浓度
三个处理为:对照日粮;对照日粮添加微囊包埋OA和NIF混合物
对照组仔猪胃肠道各段均未检出山梨酸。试验结果以“平均值±标准误”表示(n=5)。a、b:在同一段胃肠道中,不同字母表明P<0.05。
对照组仔猪胃肠道中未检出香草醛(<0.66nmol/L)。PB和NPB组仔猪胃内容物中香草醛浓度无明显差异(P=0.65,PB组153.8 ± 20.80nmol/g DM,NPB组136.4 ± 31.03nmol/g DM)。PB组仔猪空肠头段和尾段中均检测出香草醛(浓度分别为73.34 ± 19.23 nmol/gDM和84.74 ± 33.24 nmol/gDM)。而NPB组空肠头段到结肠中均未检出香草醛(<0.66 p="">0.27)。
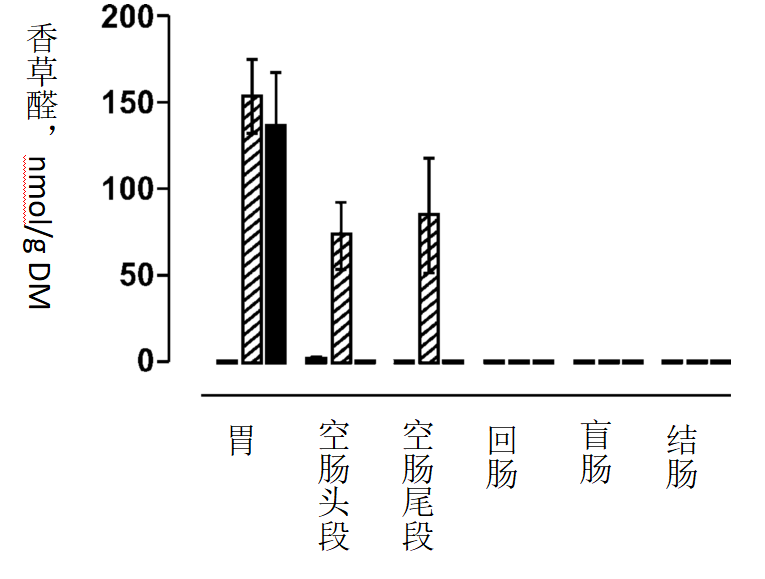
图2 测定各处理组仔猪胃肠道中香草醛浓度
三个处理为:对照日粮;对照日粮添加微囊包埋OA和NIF混合物
对照日粮添加相同OA和NIF混合物,并添加同种氢化植物油粉末,但有效成分不经微囊包埋
对照组仔猪胃肠道各段均未检出香草醛。试验结果以“平均值±标准误”表示(n=5)。
与PB和NPB组相比,对照组仔猪结肠中总短链脂肪酸浓度更高,胃(P=0.001)、空肠头段(P<0.001)和结肠(P<0.001)中异丁酸浓度更高(见表2)。
表2 仔猪采食试验日粮后胃肠道pH值、氨浓度以及短链脂肪酸摩分数
胃肠道 | 处理1 | pH | 氨 | 乙酸 | 丙酸 | 异丁酸 | 丁酸 | 异戊酸 | 戊酸 | 乳酸 | 总短链脂肪酸2 |
μmol/g DM | |||||||||||
胃3 | 对照 | 3.61 | 20.7 | 0.68 | 0.01 | 0.08b | 0.01 | ND4 | ND | 5.23 | 0.78 |
PB | 3.48 | 16.33 | 0.65 | 0 | 0.03a | 0 | ND | ND | 2.63 | 0.69 | |
NPB | 3.66 | 15.97 | 0.84 | 0 | 0.01a | 0.01 | ND | ND | 2.63 | 0.88 | |
合并标准误 | 0.146 | 2.719 | 0.139 | 0.003 | 0.013 | 0.005 | ND | ND | 0.742 | 0.157 | |
模型P值,< | 0.673 | 0.419 | 0.917 | 0.345 | 0.01 | 0.446 | ND | ND | 0.068 | 0.734 | |
空肠 头段 | 对照 | 4.97 | 34.57 | 1.23 | ND | 0.14b | ND | ND | ND | 7.33b | 1.37 |
PB | 5.15 | 36.04 | 2.01 | ND | 0.06a | 0.02 | ND | ND | 4.88ab | 2 | |
NPB | 5.34 | 35.9 | 1.72 | 0.01 | 0.01a | 0.01 | ND | ND | 3.42a | 1.84 | |
合并标准误 | 0.257 | 7.301 | 0.262 | 0.001 | 0.019 | ND | ND | ND | 0.792 | 0.283 | |
模型P值,< | 0.32 | 0.988 | 0.213 | 0.001 | 0.001 | ND | ND | ND | 0.021 | 0.417 | |
空肠 尾段 | 对照 | 5.31a | 35.59 | 1.74 | ND | 0.1 | ND | ND | ND | 12.58b | 1.76 |
PB | 5.31a | 41.81 | 2.19 | 0 | 0.08 | ND | ND | ND | 15.04b | 2.27 | |
NPB | 6.10b | 32.52 | 3.36 | 0.01 | 0.05 | ND | ND | ND | 3.07a | 3.22 | |
合并标准误 | 0.195 | 3.935 | 0.476 | 0.007 | 0.022 | ND | ND | ND | 2.42 | 0.518 | |
模型P值,< | 0.022 | 0.274 | 0.101 | 0.457 | 0.352 | ND | ND | ND | 0.019 | 0.279 | |
回肠 | 对照 | 5.44 | 52.98 | 1.12a | 0.01 | 0.04 | 0.01a | ND | ND | 7.2 | 1.24 |
PB | 5.09 | 50.96 | 0.98a | 0.01 | 0.04 | 0.01a | ND | ND | 8.36 | 0.98 | |
NPB | 6.07 | 54.14 | 6.31b | 0.04 | 0.05 | 0.26b | ND | ND | 4.12 | 4.96 | |
合并标准误 | 0.31 | 4.741 | 0.324 | 0.017 | 0.006 | 0.057 | ND | ND | 1.177 | 0.82 | |
模型P值,< | 0.326 | 0.893 | 0.001 | 0.325 | 0.764 | 0.014 | ND | ND | 0.066 | 0.04 | |
盲肠 | 对照 | 5.5 | 26.25 | 9.94 | 5.9 | 0.03 | 2.43 | 0.02 | 0.35a | 0.64b | 17.12 |
PB | 5.47 | 28.08 | 12.39 | 7.06 | 0.05 | 3.66 | 0.03 | 0.65b | 0.36ab | 23.85 | |
NPB | 5.27 | 21.69 | 13.87 | 6.83 | 0.02 | 3.55 | 0.03 | 0.25a | 0.15a | 24.11 | |
合并标准误 | 0.066 | 4.733 | 1.659 | 0.898 | 0.016 | 0.471 | 0.007 | 0.083 | 0.057 | 2.956 | |
模型P值,< | 0.06 | 0.629 | 0.278 | 0.634 | 0.499 | 0.166 | 0.537 | 0.022 | 0.007 | 0.274 | |
结肠 | 对照 | 5.55 | 1.28 | 24.80b | 13.72b | 0.21b | 5.62 | 0.15b | 1.01c | 0.22b | 45.71b |
PB | 5.63 | 3.32 | 13.61a | 7.32a | 0.09a | 3.9 | 0.05a | 0.61b | 0.07ab | 25.58ab | |
NPB | 5.51 | 3.95 | 12.41a | 6.08a | 0.08a | 3.55 | 0.05a | 0.26a | 0.05a | 20.07a | |
合并标准误 | 0.085 | 1.252 | 2.698 | 1.648 | 0.016 | 0.64 | 0.007 | 0.065 | 0.024 | 4.735 | |
模型P值,< | 0.596 | 0.38 | 0.033 | 0.015 | 0.001 | 0.089 | 0.001 | 0.001 | 0.012 | 0.018 | |
a-c同一列中,不同上标表明差异显著(P<0.05)
1对照日粮;PB=对照日粮添加微囊包埋OA和NIF混合物;NPB=对照日粮添加相同OA和NIF混合物,并添加同种氢化植物油粉末,但有效成分不经微囊包埋
2总短链脂肪酸不包括乳酸
3数据以“平均值±标准误”表示
4ND表示未检出
NPB组仔猪空肠头段和尾段、盲肠、结肠中乳酸浓度均低于对照组(P < 0.02)。PB组各段肠道内容物中乳酸浓度(计算曲线下面积,Ritschel, 1992)均低于对照组和PB组(P=0.03,NPB组14.73μmol/g DM、对照组30.05μmol/g DM、PB组29.99μmol/g DM,合并标准误=4.12)。
三个处理间,空肠尾段乳酸菌计数不存在差异(P=0.08,见图3),而NPB组盲肠中乳酸菌数量显著低于对照组和PB组(P=0.03,NPB组9.41 log cfu/g内容物、对照组10.14 log cfu/g内容物、PB组10.08 log cfu/g内容物,合并标准误=0.14)。与乳酸菌结果相反,PB组空肠尾段和盲肠中大肠菌群平板计数显著低于NPB和对照组(P< 0.03,空肠尾段大肠菌群计数:PB 6.35 log cfu/g内容物、NPB 7.99 log cfu/g内容物、对照组8.09 log cfu/g内容物,合并标准误=0.195;盲肠大肠菌群计数:PB 6.78 log cfu/g内容物、NPB 7.58 log cfu/g内容物、对照组7.99 log cfu/g内容物,合并标准误=0.24,见图4)。
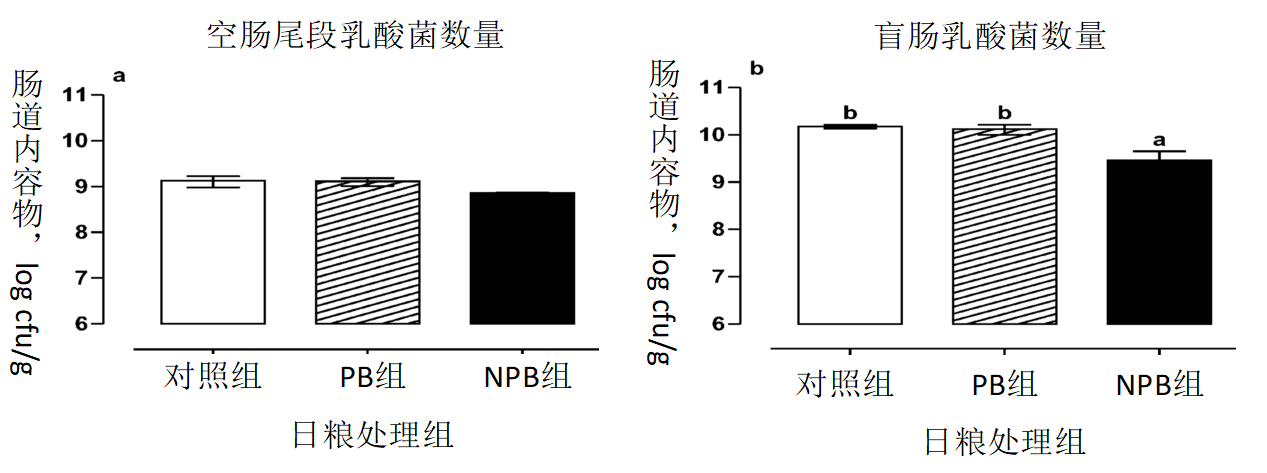
图3 空肠尾段(a)和盲肠(b)乳酸菌平板计数
日粮处理为:对照日粮(白色柱);对照日粮添加微囊包埋OA和NIF混合物(PB,条纹柱);对照日粮添加相同OA和NIF混合物,并添加同种氢化植物油粉末,但有效成分不经微囊包埋(NPB,黑色柱),从三个处理仔猪中采集样本。数据以“平均值±标准误”表示(n=5)。a、b:在同一段胃肠道中,不同字母表明P<0.05。

图4 空肠尾段(a)和盲肠(b)大肠菌群平板计数
日粮处理为:对照日粮(白色柱);对照日粮添加微囊包埋OA和NIF混合物(PB,条纹柱);对照日粮添加相同OA和NIF混合物,并添加同种氢化植物油粉末,但有效成分不经微囊包埋(NPB,黑色柱),从三个处理仔猪中采集样本。数据以“平均值±标准误”表示(n=5)。a、b:在同一段胃肠道中,不同字母表明P<0.05。
讨论
随着欧盟禁止抗生素用作生长促进剂,迫使人们不得不仔细思考肠道微生物平衡与饲料难消化部分发酵能力之间脆弱的平衡关系。由于饲料原料的质量和可利用率波动较大,因此研究能够顺利通过胃部屏障调节肠道菌群的替代方法十分有必要。
影响肠道微生物区系的因素包括有机酸(Partanen and Mroz, 1999)、天然等同香料(Penalver et al., 2005)、酶(Kim et al., 2003)、益生元(Gibson,1998)和益生菌(Klaenhammer, 2000)等等。这些物质的效果似乎与环境中细菌的攻击有关。仔猪断奶时胃肠道上皮细胞会发生改变,导致仔猪消化功能障碍(Boudry et al., 2004),并时常伴随着产毒性大肠杆菌入侵机体。因此仔猪十分容易感染腹泻(Kyriakis,1989)。与饲料相关的措施可以缓解疾病症状(Melin and Wallgren, 2002)。有机酸常被用来控制仔猪断奶后腹泻和水肿(Tsiloyianniset al., 2001a,b)。天然等同香料,如香草醛、香芹酚或百里香酚也同样被证实在食品系统中具有抗菌作用(Burt et al., 2005; Falcone et al.,2005)。
本实验表明,山梨酸和香草醛可从胃肠道内容物中回收,而不会干扰到其他成分的作用,因为对照仔猪的消化液中不存在这两种物质。胃内容物分析结果表明,不管是微囊包埋还是未包埋,两组中山梨酸和香草醛浓度相同。
PB组仔猪饲喂后,山梨酸和香草醛浓度在通过胃后没有立刻下降,和NPB组观察到的结果一致。而与此相反,空肠头段、尾段中山梨酸和香草醛浓度逐渐下降,这可能和消化酶的作用有关。通常饲料采食8-10h后食糜仍停留在小肠中(Piva et al., 1997),因此小肠中的各种化学和物理因素可降解脂质保护层,使得内容物释放并被代谢。脂质保护层可以保护山梨酸不被代谢,并使胃中测得的山梨酸总量的15%到达结肠。
Piva等(1997)研究了母猪对保护和未保护形式的色氨酸和磺胺二甲嘧啶的吸收情况,并得出结论:保护层延缓了有效成分的吸收,但不会影响其总生物利用率。PB组胃肠道内容物中的山梨酸浓度变化表明了其从微胶囊中被缓慢释放出来。胃中的山梨酸沿胃肠道回收率逐渐下降(P<0.01,空肠头段、空肠尾段、回肠、盲肠和结肠的回收率分别为44%,35%,22%,29%和15%)。而NPB组仔猪山梨酸浓度在通过胃后立即下降,空肠头段和尾段中仅检测到2%的山梨酸,而剩下的肠段中未检出山梨酸。脂质保护层同样可以延缓香草醛的释放,具体表现为空肠头段和尾段中香草醛浓度分别为胃中浓度的48%和55%(P<0.05)。
与香草醛相比,山梨酸沿胃肠道的回收程度不断增加,但这与山梨酸的水溶性较低并无关系(30℃山梨酸溶解度为0.25%质量浓度,25℃香草醛溶解度为1%质量浓度)。pKa>3的弱酸(如山梨酸pKa为4.76)能被很好的吸收(Baggot, 1977),且离子形式的酸可以通过肠黏膜。NPB组山梨酸在空肠头段中很快被吸收,而脂质包埋组可延缓山梨酸的释放,确保其能够到达后面具有相关微生物活性的肠段。有机酸具有抗微生物作用主要是因为:未解离形式的有机酸可自由扩散穿过微生物细胞半透膜,并进入细胞质(Partanenand Mroz, 1999),其中细胞质pH接近7,在此条件下弱酸解离并可抑制微生物细胞酶活性和养分转运系统(Lueck, 1980)。
Sofos等(1985)研究表明,只有饲喂了山梨酸(添加量0.04%)的肉鸡十二指肠中大肠菌群数量减少。本实验中PB组仔猪空肠和盲肠中观察到的结果相似,其中PB组大肠菌群平板计数低于NPB组,这是因为PB组山梨酸浓度更高。
NPB组猪的空肠(P = 0.08)和盲肠(P = 0.006)中乳酸菌平板计数有降低的趋势,可能会导致仔猪空肠尾段中乳酸浓度降低、pH值升高。Canibe等(2005)给生长猪添加18g/kg的甲酸时,结果呈现类似的阴性模式。当给猪饲喂微囊包埋混合物时,未观察到乳酸浓度的降低。
目前尚未发现相关文献研究有机酸和天然等同香料对猪胃肠道微生物区系的协同作用。天然等同香料的抗菌作用机制包括其对细胞膜的作用(Burt, 2004),这是有机酸进入细菌细胞之前遇到的第一道屏障。在天然等同香料的作用下质膜通透性增强,可帮助有机酸进入细菌细胞,从而改变细菌代谢(Brul and Coote, 1999)。
用脂质保护层给有机酸和天然等同香料进行微囊包埋,可确保活性成分缓慢释放,避免在胃中迅速损失。活性化合物在胃肠道中保持的时间越久,它们就能协同调节肠道菌群,并减少大肠菌群数量。

